Bij het reguleren van de schildklierhormoonhuishouding zijn er verschillende hormonen betrokken,…
Biofilms opruimen met voeding en kruiden
We hebben vaak te maken met biofilms met terugkerende (laaggradige)ontstekingen. Denk aan: bronchitis, cystitis, colitis, paradontitis, vaginitis, maar ook bij diabetes, atherosclerose, leververvetting, huidziekten, etc. Als deze ziekten veroorzaakt worden door een bacterie, virus of schimmel, dan is er sprake van het fenomeen van biofilms.
Wat is een biofilm?
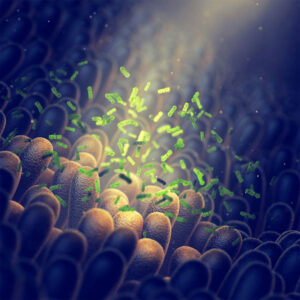 Biofilms bestaan uit een laag micro-organismen omgeven door zelfgeproduceerd slijm, die zich vasthechten aan een oppervlak. Tandplak is daar een voorbeeld van en voor de industrie kan biofilmvorming hinderlijk zijn wegens het dichtslibben van leidingen; naast verstoppingen en klontervorming kan dit ook tot corrosie leiden. In de geneeskunde kunnen ze moeilijk bestrijdbare besmettingen veroorzaken; bijvoorbeeld in katheters, maar ook in de luchtpijp van mucoviscidosepatiënten. Bacteriën in biofilms zijn beter bestand tegen toxische stoffen en antibiotica.
Biofilms bestaan uit een laag micro-organismen omgeven door zelfgeproduceerd slijm, die zich vasthechten aan een oppervlak. Tandplak is daar een voorbeeld van en voor de industrie kan biofilmvorming hinderlijk zijn wegens het dichtslibben van leidingen; naast verstoppingen en klontervorming kan dit ook tot corrosie leiden. In de geneeskunde kunnen ze moeilijk bestrijdbare besmettingen veroorzaken; bijvoorbeeld in katheters, maar ook in de luchtpijp van mucoviscidosepatiënten. Bacteriën in biofilms zijn beter bestand tegen toxische stoffen en antibiotica.
In voedselproducerende instellingen zoals fabrieken en keukens bemoeilijken ze het schoonmaken. Ook in waterleidingen, waterfilters en ventilatiekanalen komen biofilms voor, die beter bestand zijn tegen detergenten (reinigingsmiddelen).
Ziekmakende bacteriën, schimmels, virussen kunnen zichzelf beschermen tegen ons immuunsysteem of tegen een antibioticakuur of medicatie, door een slijmlaag aan te maken waaraan ze zich als cluster (biofilm) hechten. In deze vorm van ‘schuilplaats’ zijn ze bovendien nauwelijks nog aantoonbaar met diverse onderzoeksmethoden. Ook leidt dit regelmatig tot antibioticaresistentie. Schimmels als Candida zijn vaak therapieresistent door deze biofilms en worden daardoor ongevoelig voor anti-schimmelmedicatie.
Darmmicrobioom en biofilms
De darm is een bijzonder dynamische omgeving waarin de gastheer voortdurend in wisselwerking staat met triljoenen symbiotische bacteriën, de microbiota genaamd. Met behulp van quorum sensing (QS)-communicatie kunnen bacteriën hun sociale gedrag coördineren en gastheercelactiviteiten op een niet-invasieve manier beïnvloeden. Tegenwoordig heeft een grote hoeveelheid onderzoek het begrip enorm gestimuleerd van hoe bacteriële QS-communicatie het bacteriële coöperatieve gedrag reguleert als gevolg van co-existentie en gastheer-microbe-interacties.
 Bacteriële communicatie is afhankelijk van veelzijdige chemische signaalmoleculen.Net als talen tussen mensen, variëren deze signalen tussen soorten. Quorum sensing stelt individuele bacteriën in kolonies in staat om kolonie-brede functies te coördineren en uit te voeren, zoals: sporenvorming, virulentie en biofilmvorming. Het vermogen om biofilms te vormen in zijn gastheer zorgt voor het succes van de reproductiecyclus van de bacterie en de uiteindelijke afscheiding van toxinen die een cytokinenstorm ontketenen (ontstekingen).
Bacteriële communicatie is afhankelijk van veelzijdige chemische signaalmoleculen.Net als talen tussen mensen, variëren deze signalen tussen soorten. Quorum sensing stelt individuele bacteriën in kolonies in staat om kolonie-brede functies te coördineren en uit te voeren, zoals: sporenvorming, virulentie en biofilmvorming. Het vermogen om biofilms te vormen in zijn gastheer zorgt voor het succes van de reproductiecyclus van de bacterie en de uiteindelijke afscheiding van toxinen die een cytokinenstorm ontketenen (ontstekingen).
Het is verontrustend dat sommige bacteriesoorten quorum-sensing lijken te gebruiken om elkaars virulentie te versterken, zoals de Pseudomonas aeruginosa. Ook de Porphyromonas gingivalis en Streptococcus goronii doen dit, een symbiotische relatie die zorgt voor een zeer krachtige parodontitis-co-infectie.
In een gezond darmmicrobioom (kolonisatie van microbiota die biofilms tegen gaan) huizen minder potentieel pathogene micro-organismen die biofilms aanmaken (zoals de Pseudomonas, E-coli, Helicobacter Pylori, Staphylococcus Aureus, Salmonella, Citrobacter, Klebsiella, enterobacteriën, Clostridium diff.). Fusobacterium nucleatum veroorzaakt darmziekten in de vorm van invasieve biofilms.
Er is een constante interactie tussen de epitheelcellen en de darmmicrobiota, die beide betrokken zijn bij de regulatie van de darmbarrièrefunctie. De commensale microbiota is in staat om de darmbarrièrestructuur vorm te geven door de fysiologische paracellulaire permeabiliteit te beheersen en de slijmlaag te versterken.
Verdediging tegen biofilms
 De darmbarrières, fysiek of biologisch, voorkomen dat ziekteverwekkers het lichaam binnendringen. Ze bestaan uit vier onderling afhankelijke componenten, namelijk de eerste verdedigingslaag: het continue darmepitheel, de slijmlaag, de mucosale immuniteit en de darmmicrobiota. Het epitheeloppervlak van het darmkanaal vormt een fysieke barrière tegen de ‘buitenkant’ en vormt zo een eerste weerstandslaag tegen infecties.
De darmbarrières, fysiek of biologisch, voorkomen dat ziekteverwekkers het lichaam binnendringen. Ze bestaan uit vier onderling afhankelijke componenten, namelijk de eerste verdedigingslaag: het continue darmepitheel, de slijmlaag, de mucosale immuniteit en de darmmicrobiota. Het epitheeloppervlak van het darmkanaal vormt een fysieke barrière tegen de ‘buitenkant’ en vormt zo een eerste weerstandslaag tegen infecties.
De tweede verdedigingslaag tegen binnendringende pathogene micro-organismen en immunogene componenten is de slijmlaag, een gehydrateerde gel die het oppervlak van het darmslijmvlies bedekt. De slijmlaag bestaat uit mucine uitgescheiden door slijmbekercellen en antimicrobiële eiwitten geproduceerd door Paneth-cellen. Het creëert een beschermende omgeving voor de darmmicrobiota en vooral voor bacteriën die gedijen in de buurt van de epitheelcellen.
De derde verdedigingslaag wordt geleverd door de intestinale mucosale immuniteit, inclusief darm-geassocieerde lymfoïde weefsels (GALT), secretoire immunoglobuline A (sIgA), antimicrobiële peptiden (defensines of lysozymen) en mucosale immuuncellen (zoals Th1-, Th2- en Treg-cellen).
De vierde verdedigingslaag is de darmmicrobiota. De microbiota verhindert door competitie dat ziekteverwekkers het darmslijmvlies binnendringen. Dit mechanisme wordt “kolonisatieresistentie” genoemd en wordt geassocieerd met QS. Mucine motiveert, samen met sIgA, microbiële activiteit door zich te binden aan een “normale, gezonde” microbiota .
Biofilms: vroege waarschuwing

Biofilms bieden een beschermend omhulsel voor pathogene bacteriën om de verdediging van de gastheer te ontwijken. Ze zijn een ideale omgeving voor pathogene bacteriën om virulentie op te bouwen, dus het optreden van enkele volwassen biofilms op gezonde weefsels kan een vroeg waarschuwingssignaal zijn voor de overgang naar een beschadigde darm. Een verhoogde hoeveelheid hechtende invasieve E. coli – vormende biofilms wordt bijvoorbeeld in verband gebracht met het optreden van colitis ulcerosa.
Aan de andere kant zouden biofilms gevormd in de gezonde darm een gunstige functie uitoefenen op de gastheer door de functies te versterken die door de microbiota worden gediend, zoals het verbeteren van de afweer van de gastheer. Deze biofilms verlengen de verblijftijd van bacteriën in de darm aanzienlijk, waardoor de uitwisseling van voedingsstoffen tussen microbiota en de gastheer wordt verbeterd. De vorming van probiotische biofilms is een gunstige eigenschap voor de gastheer, het bevordert de kolonisatie en een langere persistentie van nuttige bacteriën in het darmslijmvlies, waardoor kolonisatie van pathogenen wordt uitgesloten.
Het is vermeldenswaard dat sIgA bekend staat om zijn vermogen om biofilmvorming te remmen door immuunafstoting te agglutineren, waardoor translocatie van de epitheliale barrière wordt voorkomen. De afgifte van sIgA is afhankelijk van de kolonisatie van bacteriën in de darm. SIgA voorkomt bacteriële aggregatie en adhesie door cellen in een planktonische toestand te houden en de expressie van biofilm-geassocieerde genen in pathogenen neerwaarts te reguleren.
Vetzuren met een korte keten (SCFA) zijn een van de belangrijke metabolieten van darmmicroben, voornamelijk samengesteld uit acetaat, propionaat en butyraat, maar andere, zoals lactaat en valeraat, worden ook geproduceerd door microbiota.
 Als signaalmoleculen hebben ze verschillende effecten op de gastheer, zoals het reguleren van het gastheermetabolisme, het handhaven van de intestinale homeostase en het versterken van het immuunsysteem. Gezonde darmmicrobiota produceert een adequate en uitgebalanceerde SCFA als een belangrijke manier om infectie met pathogenen te voorkomen. Azijnzuur remt extracellulaire polysachariden en vertoont anti-quorum sensing-activiteit in E. coli, wat uiteindelijk leidt tot een vermindering van biofilmvorming.
Als signaalmoleculen hebben ze verschillende effecten op de gastheer, zoals het reguleren van het gastheermetabolisme, het handhaven van de intestinale homeostase en het versterken van het immuunsysteem. Gezonde darmmicrobiota produceert een adequate en uitgebalanceerde SCFA als een belangrijke manier om infectie met pathogenen te voorkomen. Azijnzuur remt extracellulaire polysachariden en vertoont anti-quorum sensing-activiteit in E. coli, wat uiteindelijk leidt tot een vermindering van biofilmvorming.
Het belang van probiotica voor het behoud van de menselijke gezondheid staat buiten kijf en onderzoek naar gezonde biofilm is recentelijk een hot topic geworden. Een herstellend of beschermend effect van bepaalde stammen van probiotica op de fecale microbiële gemeenschap en gastheerfysiologie, bijv. verlichting van gastro-intestinale symptomen waar dysbiose aanwezig is of waar de microbiota verstoord is.
Probiotica worden beschouwd als een dieetbenadering voor de wijziging van de darmmicrobiota om de gezondheid van de gastheer te verbeteren. De darmmicrobiota wordt gebruikt als een nieuw therapeutisch doelwit om de chronische ontsteking te verminderen. [1-2]
Aanmaak biofilms voorkomen met voedingsstoffen en kruiden
Hieronder opties die succesvol lijken in het voorkomen van biofilms of bijdragen aan de afbraak ervan:
 Voedingsmiddelen:
Voedingsmiddelen:
- Kefir (rauwpower Kefir en yoghurt)
- Gefermenteerde groenten
- Uien, rode kool (quercitine)
- Blauwe bessen (resveratrol)
- Paddenstoelen (extracten)
- Manukahoning (actief tegen de Pseudomonas aeruginosa)
Kruiden/specerijen:
- Knoflook (allicine)
- Zwarte/gefermenteerde knoflook
- Kaneel (cinnemaldehyde)
- Kurkuma (curcumine)
- Gember (gingerol)
- Groene thee (EGCG)
- Zwarte komijn
- Ashwagandha ghee Bio
- Berberine
 Quercitine ondersteunt de darmbarrièrefunctie en voorkomt een ‘lekkende darm’ (door defecte tight junctions) en gaat (darm) ontsteking tegen. Quercetine zorgt voor versterking van tight junctions. Het verhoogt de expressie van tight -junctioneiwitten zoals zona occludens -2, occludine, en claudine -4, mede door regulatie van proteïnekinases).
Quercitine ondersteunt de darmbarrièrefunctie en voorkomt een ‘lekkende darm’ (door defecte tight junctions) en gaat (darm) ontsteking tegen. Quercetine zorgt voor versterking van tight junctions. Het verhoogt de expressie van tight -junctioneiwitten zoals zona occludens -2, occludine, en claudine -4, mede door regulatie van proteïnekinases).
Ook zorgt het voor verhoging van de mucusproductie door enterocyten en slijmbekercellen (gobletcellen). Het heeft antimicrobiële effecten tegen (ontstekingsbevorderende) voedselpathogenen en verzorgt de regulatie van de mucosale immuniteit (ontstekingsremming, immunomodulatie). [3-6]
Quercetine remt de vorming van bacteriële biofilms en/of heeft sterke bacteriostatische activiteit tegen diverse soorten bacteriën, waaronder Salmonella enterica Typhimuricum, Pseudomonas aeruginosa, Helicobacter pylori, Staphylococcus aureus, Porphyromonas gingivalis, Yersinia enterocolitica, Campylobacter jejuni, Streptococcus mutans, Enterococcus faecalis, Bacillus subtilis, Listeria monocytogenes en Escherichia coli.
Daarnaast remt quercetine de groei van schimmels zoals Candida albicans, Cryptococcus neoformans en Aspergillus niger. Ook tegen parasieten is quercitine actief bezig, zoals Toxoplasma (gondii), Babesia, Trypanosoma (brucei), Leishmania (donovani), Plasmodium (falciparum) en Theileria.
 Resveratrol heeft (in-vitro) antibacteriële activiteit tegen onder meer Escherichia coli, Bacillus cereus, Helicobacter pylori, Haemophilus influenzae, Vibrio cholerae, Salmonella typhimurium, Listeria monocytogenes, Propionibacterium acnes, Campylobacter coli en Mycobacterium tuberculosis.
Resveratrol heeft (in-vitro) antibacteriële activiteit tegen onder meer Escherichia coli, Bacillus cereus, Helicobacter pylori, Haemophilus influenzae, Vibrio cholerae, Salmonella typhimurium, Listeria monocytogenes, Propionibacterium acnes, Campylobacter coli en Mycobacterium tuberculosis.
Daarnaast remt resveratrol diverse schimmels (waaronder Candida albicans) en parasieten (Leishmania, Toxoplasma gondii, Trypanosoma cruzi). Resveratrol heeft ook antimicrobiële activiteit tegen bacteriën en schimmels die huidinfecties veroorzaken (Staphylococcus aureus, Enterococcus faecalis, Pseudomonas aeruginosa, Trichophyton, Epidermophyton en Microsporum). Plus antimicrobiële activiteit tegen bacteriën die geassocieerd zijn met cariës (Streptococcus mutans) en periodontitis (Porphyromonas gingivalis). [7-15]
Berberine heeft significante antimicrobiële activiteit tegen pathogene bacteriën, virussen, schimmels en parasieten (protozoa, wormen), en gunstige darmbacteriën zoals lactobacillen en bifidobacteriën ongemoeid laat.
Remming van aanhechting van micro-organismen aan gastheercellen (biofilmvorming) is te bereiken met een (veel) lagere dosis berberine dan die nodig is voor het remmen van vermeerdering, of het doden van micro-organismen. Berberine kan in lagere dosis worden ingenomen als antimicrobiële profylaxe (remming biofilmvorming) en in hogere dosis als antimicrobiële therapie (tevens remmen en eventueel doden van micro-organismen). [16-20]
 Groene thee catechines, met name EGCG en ECG, hebben antimicrobiële effecten tegen bacteriën, virussen, schimmels en parasieten. Antimicrobiële activiteit tegen (entero)pathogenen is onder meer aangetoond tegen Staphylococcus aureus, Propionibacterium acnes, Helicobacter pylori, HIV (humaan immunodeficiëntievirus), Pseudomonas aeruginosa, Vibrio parahemolyticus, Clostridium (difficile, perfringens), Escherichia coli, Bacillus cereus, Plesiomonas shigelloides, Blastocystis hominis, Listeria monocytogenes, Plasmodium falciparum en Candida albicans.
Groene thee catechines, met name EGCG en ECG, hebben antimicrobiële effecten tegen bacteriën, virussen, schimmels en parasieten. Antimicrobiële activiteit tegen (entero)pathogenen is onder meer aangetoond tegen Staphylococcus aureus, Propionibacterium acnes, Helicobacter pylori, HIV (humaan immunodeficiëntievirus), Pseudomonas aeruginosa, Vibrio parahemolyticus, Clostridium (difficile, perfringens), Escherichia coli, Bacillus cereus, Plesiomonas shigelloides, Blastocystis hominis, Listeria monocytogenes, Plasmodium falciparum en Candida albicans.
Groene thee catechines stimuleren de vermeerdering van probiotische melkzuurbacteriën (prebiotisch effect), terwijl enteropathogenen (zoals Staphylococcus aureus, Streptococcus pyogenes, Clostridium difficile) worden aangevallen.[24-35]
Ashwagandha-extract (wortel, blad) laat in onderzoeken antimicrobiële activiteit zien van tegen onder meer E.coli, Salmonella typhi, Staphylococcus aureus, Streptococcus mutans, Citrobacter freundii, Pseudomonas aeruginosa, Proteus mirabilis, Klebsiella pneumoniae en Candida albicans. [36-39]
Paddenstoelen(extracten) kunnen een bron van natuurlijke antimicrobiële stoffen zijn. De huidige studies rapporteren het vermogen van extracten van wilde paddenstoelen om in vitro biofilmvorming door multiresistente bacteriën te remmen (Escherichia coli, Proteus mirabilis, Pseudomonas aeruginosa en Acinetobacter baumannii). Pseudomonas aeruginosa was het micro-organisme met de hoogste capaciteit voor biofilmproductie, en was ook het meest vatbaar voor de remmingscapaciteit van paddenstoelenextracten. [40-41]

Referenties
[1] Zhaoxi Deng, Xin M. Luo, Jianxin Liu1 and Haifeng Wang. Quorum Sensing, Biofilm, and Intestinal Mucosal Barrier: Involvement the Role of Probiotic. Front. Cell. Infect. Microbiol., 25 September 2020. https://www.frontiersin.org/articles/10.3389/fcimb.2020.538077/full
[2] Baumgartner, M., et al. (2021) Mucosal biofilms are an endoscopic feature of irritable bowel syndrome and ulcerative colitis. Gastroenterology. https://www.gastrojournal.org/article/S0016-5085(21)03138-3/fulltext
[3] Lee B et al. Tight junction in the intestinal epithelium: its association with diseases and regulation by phytochemicals. J Immunol Res. 2018;2018:2645465.
[4] Damiano S et al. Quercetin increases MUC2 and MUC5AC gene expression and secretion in intestinal goblet cell-like LS174T via PLC/PKCα/ERK1-2 pathway. Front Physiol. 2018;9:357.
[5] Suzuki T et al. Quercetin enhances intestinal barrier function through the assembly of zonula [corrected] occludens-2, occludin, and claudin-1 and the expression of claudin-4 in Caco-2 cells. J Nutr. 2009;139(5):965-74.
[6] Lin R et al. Dietary quercetin increases colonic microbial diversity and attenuates colitis severity in Citrobacter rodentium-infected mice. Front Microbiol. 2019;10:1092.
[7] Vestergaard M et al. Antibacterial and antifungal properties of resveratrol. Int J Antimicrob Agents. 2019;53(6):716-723.
[8] Bostanghadiri N et al. Comprehensive review on the antimicrobial potency of the plant polyphenol resveratrol. Biomed Pharmacother. 2017;95:1588-1595.
[9] Euba B et al. Resveratrol therapeutics combines both antimicrobial and immunomodulatory properties against respiratory infection by nontypeable Haemophilus influenzae. Sci Rep. 2017;7(1):12860.
[10] Ferreira C et al. Resveratrol is active against Leishmania amazonensis: in vitro effect of its association with amphotericin B. Antimicrob Agents Chemother. 2014;58(10):6197-208.
[11] Chen QW et al. Direct and indirect inhibition effects of resveratrol against Toxoplasma gondii tachyzoites in vitro. Antimicrob Agents Chemother. 2019;63(3):e01233-18.
[12] Chan MM. Antimicrobial effect of resveratrol on dermatophytes and bacterial pathogens of the skin. Biochem Pharmacol. 2002;63(2):99-104.
[13] Li J et al. Effects of resveratrol on cariogenic virulence properties of Streptococcus mutans. BMC Microbiol. 2020;20:99.
[14] Chin YT et al. Therapeutic applications of resveratrol and its derivatives on periodontitis. Ann N Y Acad Sci. 2017;1403(1):101-108.
[15] Yang T et al. Resveratrol, sirtuins, and viruses. Rev Med Virol. 2015;25:431-445.
[16] Chu M et al. Berberine: a medicinal compound for the treatment of bacterial infections. Clin Microbial. 2014;3:150.
[17] Bone K et al. Berberis bark and Hydrastis root. In: Principles and practice of phytotherapy. Elsevier 2013;399-418. ISBN 978-0-445-06992-5.
[18] Zhang S et al.(2018). The effect of berberine on the transcriptome and proteome of E. coli. bioRxiv. https://doi.org/10.1101/318733.
[19] Shi C et al. Combination of berberine and ciprofloxacin reduces multi-resistant Salmonella strain biofilm formation by depressing mRNA expressions of luxS, rpoE, and ompR. J Vet Sci. 2018;19(6):808-816.
[20] Costa-Orlandi CB et al. Fungal biofilms and polymicrobial diseases. J Fungi (Basel). 2017;3(2):22.
[21] Yanagawa Y et al. A combination effect of epigallocatechin gallate, a major compound of green tea catechins, with antibiotics on Helicobacter pylori growth in vitro. Curr Microbiol. 2003;47(3):244-9.
[22] Williamson MP et al. Epigallocatechin gallate, the main polyphenol in green tea, binds to the T-cell receptor, CD4: Potential for HIV-1 therapy. J Allergy Clin Immunol. 2006;118(6):1369-74.
[23] Radji M et al. Antimicrobial activity of green tea extract against isolates of methicillin-resistant Staphylococcus aureus and multi-drug resistant Pseudomonas aeruginosa. Asian Pac J Trop Biomed. 2013;3(8):663-7; discussion 666.
[24] Archana S et al. Comparative analysis of antimicrobial activity of leaf extracts from fresh green tea, commercial green tea and black tea on pathogens. J Appl Pharm Sci. 2011;1(8):149-152.
[25] Boyanova L. Comparative evaluation of the activity of plant infusions against Helicobacter pylori strains by three methods. World J Microbiol Biotechnol. 2013 Dec 31.
[26] Cho YS et al. Antibacterial effects of green tea polyphenols on clinical isolates of methicillin-resistant Staphylococcus aureus. Curr Microbiol. 2008;57:542-546.
[27] Al-Mohammed HI et al. Effect of green tea extract and cysteine proteases inhibitor (E-64) on symptomatic genotypes of Blastocystis hominis in vitro and in infected animal model. Int J Curr Microbiol App Sci. 2013;2(12):228- 239.
[28] Lee H et al. In vitro anti-adhesive activity of green tea extract against pathogen adhesion. Phytother Res. 2009;23:460-466.
[29] Isogai E et al. In vivo synergy between green tea extract and levofloxacin against enterohemorrhagic Escherichia coli O157 infection. Curr Microbiol. 2001;42(4):248-51.
[30] Kohda C et al. Epigallocatechin gallate inhibits intracellular survival of Listeria monocytogenes in macrophages. Biochem Biophys Res Commun. 2008;365(2):310-5.
[31] Sannella AR et al. Antimalarial properties of green tea. Biochem Biophys Res Commun. 2007;353(1):177- 81.
[32] Evensen NA et al. The effects of tea polyphenols on Candida albicans: inhibition of biofilm formation and proteasome inactivation. Can J Microbiol. 2009;55(9):1033- 9.
[33] Hartjen P et al. Assessment of the range of the HIV-1 infectivity enhancing effect of individual human semen specimen and the range of inhibition by EGCG. AIDS Res Ther. 2012;9(1):2.
[34] Hauber I et al. The main green tea polyphenol epigallocatechin-3-gallate counteracts semen-mediated enhancement of HIV infection. Proc Natl Acad Sci U S A. 2009;106(22):9033-8.
[35] Su P et al. Synergistic effect of green tea extract and probiotics on the pathogenic bacteria, Staphylococcus aureus and Streptococcus pyogenes. J Microbiol and biotechnology. 2008;24:1837-1842.
[36] Alam N et al. Methanolic extracts of Withania somnifera leaves, fruits and roots possess antioxidant properties and antibacterial activities. BMC Complemen Altern Med. 2012;12:175.
[37] Singh G et al. Evaluation of antimicrobial efficacy of flavonoids of Withania somnifera L. Indian J Pharm Sci. 2011;73(4):473-478.
[38] Datta S et al. Inhibition of the emergence of multi drug resistant Staphylococcus aureus by Withania somnifera root extracts. Asian Pac J Trop Med. 2011;4(11):917-20.
[39] Owais M et al. Antibacterial efficacy of Withania somnifera (ashwagandha) an indigenous medicinal plant against experimental murine salmonellosis. Phytomedicine. 2005;12:229-235.
[40] Maria José Alves. Wild mushroom extracts as inhibitors of bacterial biofilm formation. Pathogens 2014 Aug 6;3(3):667-79
[41] E Liktor-Busa. Investigation of Hungarian mushrooms for antibacterial activity and synergistic effects with standard antibiotics against resistant bacterial strains. Lett Appl Microbiol. 2016 Jun;62(6):437-43.